これで完ぺき!理科の総まとめ(身のまわりの物質)
※イラストをクリックするとデジタル教材で学習することができます。
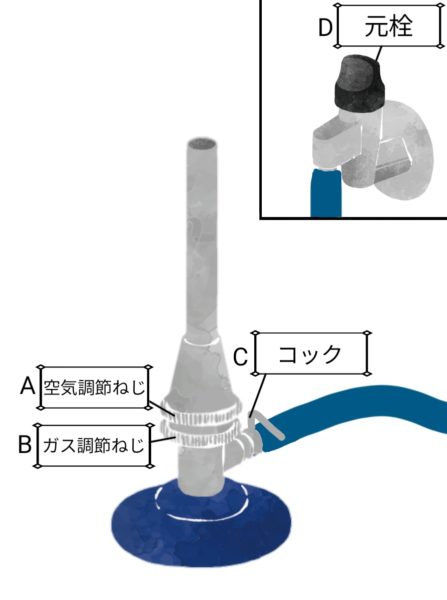
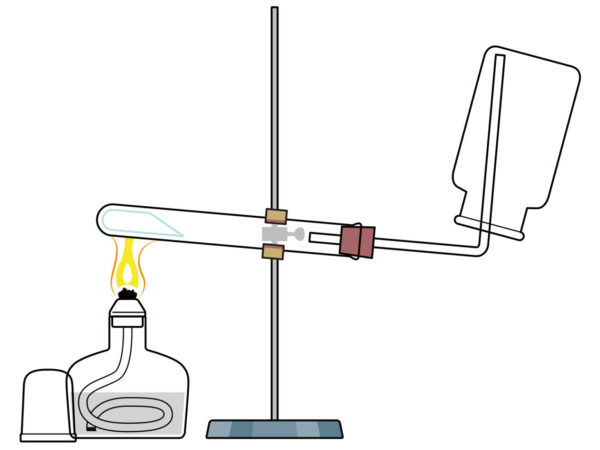
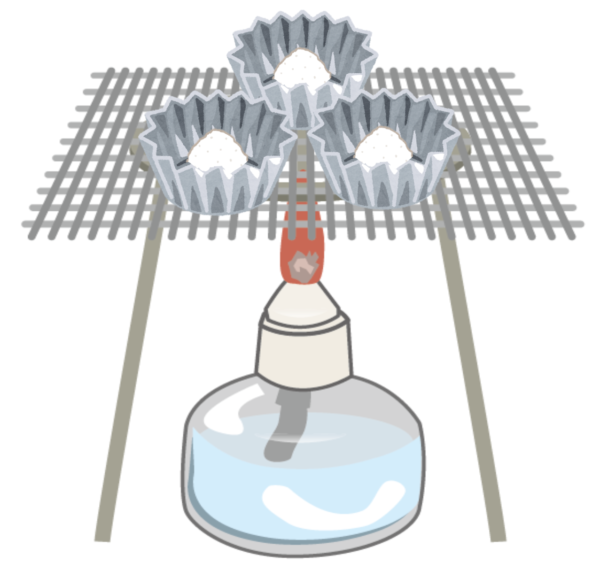
ガスバーナーの使い方
物体と物質
物体
身の回りにある形のあるもの (例)コップ

物質
物体の材料(例)紙、ガラス、プラスチック
物質を区別する方法
形、色、におい、触感、質量や体積、熱、水にとける、薬品
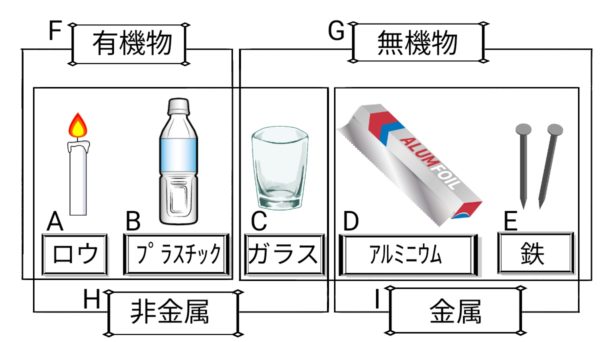
有機物と無機物の区別(白い粉末の見分け方)
有機物→焦げて、炭ができる
無機物→焦げず、炭ができない
有機物
炭素を含む物質(例)砂糖、デンプン、紙、プラスチック
有機物を熱する→焦げて炭になる、二酸化炭素と水ができる
無機物
炭素をふくまない物質(例)水、食塩、鉄
無機物を熱する→炭にならない、二酸化炭素を出さない
※炭素、一酸化炭素、二酸化炭素は炭素を含むが、無機物に分類される。
白い粉の推定実験
金属と非金属の区別
金属の性質
電気をよく通す(電気伝導性)、熱をよく伝える(熱伝導性)、みがくと光沢がでる(金属光沢)、引っ張ると細く伸びる(延生)たたくとうすく広がる(展性)

非金属
金属以外の物質
密度(質量と体積)による区別
密度シミュレーター(phet)
上皿てんびん
電子てんびん

質量を測るために使用する。
電子てんびんの使い方
- 何ものせていないときの表示を0.00gにする
- 皿に薬包紙をのせて、表示板の数値を0.00gにする
- はかりたいものを皿にのせて、数値を読み取る
メスシリンダー
液体の正確な体積を測るために使用する。

メスシリンダーの使い方
目的に合った容量のものを用意し、1目盛りの体積を確かめて目盛りを読む。目分量で1目盛りの10分の1まで読み取る。液面がへこむ場合はへこんだ下側の目盛りを読み取る。
密度

物質1㎤あたりの質量 ※つまっているかどうか
密度〔g/㎤〕=質量〔g〕÷体積〔㎤〕
※物質によって密度は決まっている → 物質を特定できる。
密度が水(1g/㎤)より小さい物質は水に浮く。
(例)
| 水 | 鉛 | 金 | 水銀 | アルミニウム | 重油 |
| 1g/㎤ | 11.35 g/㎤ | 19.32 g/㎤ | 13.55 g/㎤ | 2.70 g/㎤ | 0.8 g/㎤ |
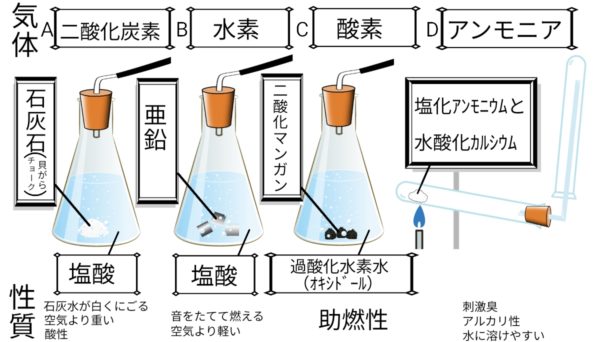
気体の性質
におい、色、軽さ、燃えるか、水にとけるか
様々な気体の性質
| 名称 | 色 | におい | 空気と比べた重さ | 水へのとけやすさ | 気体の集め方 | その他の性質 |
| 酸素 | 青 | ✘ | 少し軽い | 溶けにくい | 水上 | 助燃性 |
| 二酸化炭素 | ✘ | ✘ | 重い | 少し溶ける | 水上or下方 | 石灰水を白くにごらせる、弱酸性 |
| ちっ素 | ✘ | ✘ | ほぼ同じ | 溶けにくい | 水上 | 空気の主成分 |
| アンモニア | ✘ | 刺激臭 | 軽い | 非常によく溶ける | 上方 | アルカリ性 |
| 水素 | ✘ | ✘ | 非常に軽い | 溶けにくい | 水上or上方 | |
| 塩化水素 | ✘ | 刺激臭 | 重い | 非常によく溶ける | 下方 | 塩酸の源料、酸性 |
| 塩素 | 黄緑 | 刺激臭 | 重い | 溶けやすい | 下方 | 漂白作用 |
※色・においのないものは×
※水上置換法→水上、上方置換法→上方、下方置換法→下方 で表す
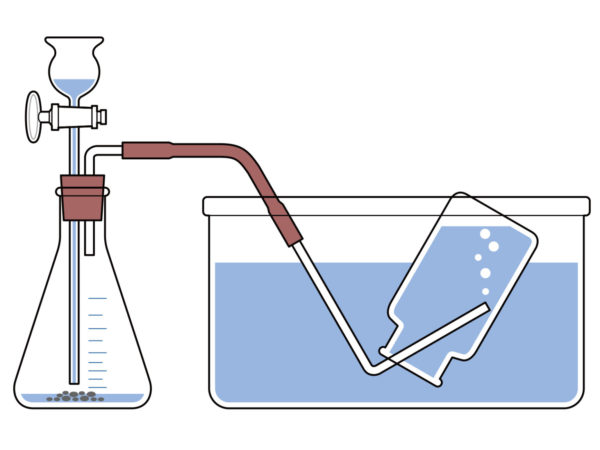
気体の集め方
水上置換法
水に溶けにくい気体(例)水素、窒素、二酸化炭素(少ししか水に溶けないため)
上方置換法
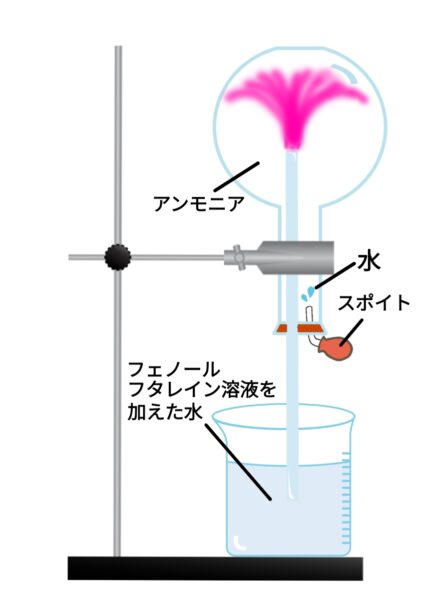
水に溶けやすく空気より軽い気体(例)アンモニア
下方置換法
水に溶けやすく空気より重い気体(例)塩化水素、塩素、二酸化炭素
アンモニアの噴水実験
水溶液の性質
水溶液
溶液
ある液体に他の物質がとけた液全体。溶質と溶媒からなる。
溶質…溶液中に溶けているもの。
溶媒…溶質を溶かす液体。
(例)
塩水 = 塩 + 水
溶液 溶質 溶媒
※溶媒が水の場合の溶液を水溶液という。
水にとける
物質が小さな粒になり、水中に均一に広がっている状態。溶液は透明で、液の濃さは均一、時間がたってもこの状態が続く

水中の粒子シミュレーター(pHet)
濃度の表し方
質量パーセント濃度…溶液を100%としたときの溶質の割合。単位はパーセント〔%〕
質量パーセント濃度〔%〕=溶質の質量〔g〕÷溶液の質量〔g〕×100
質量パーセント濃度〔%〕=溶質の質量〔g〕÷(溶質の質量〔g〕+溶媒の質量〔g〕)×100
溶質のとり出し方
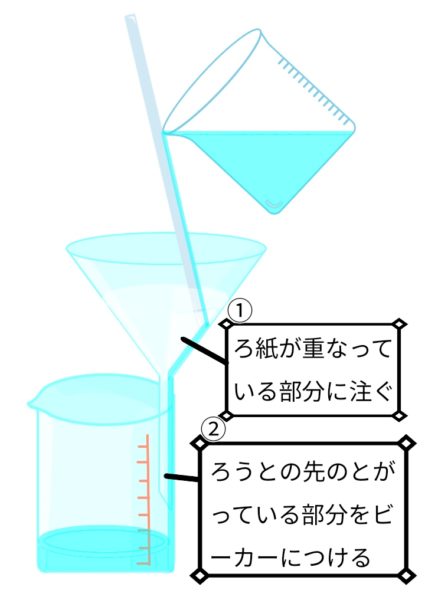
ろ過
ろ紙の折り方
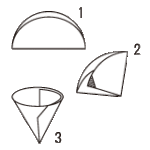
飽和
物質がそれ以上とけきれなくなるまでとけている状態。飽和している水溶液を飽和水溶液という。
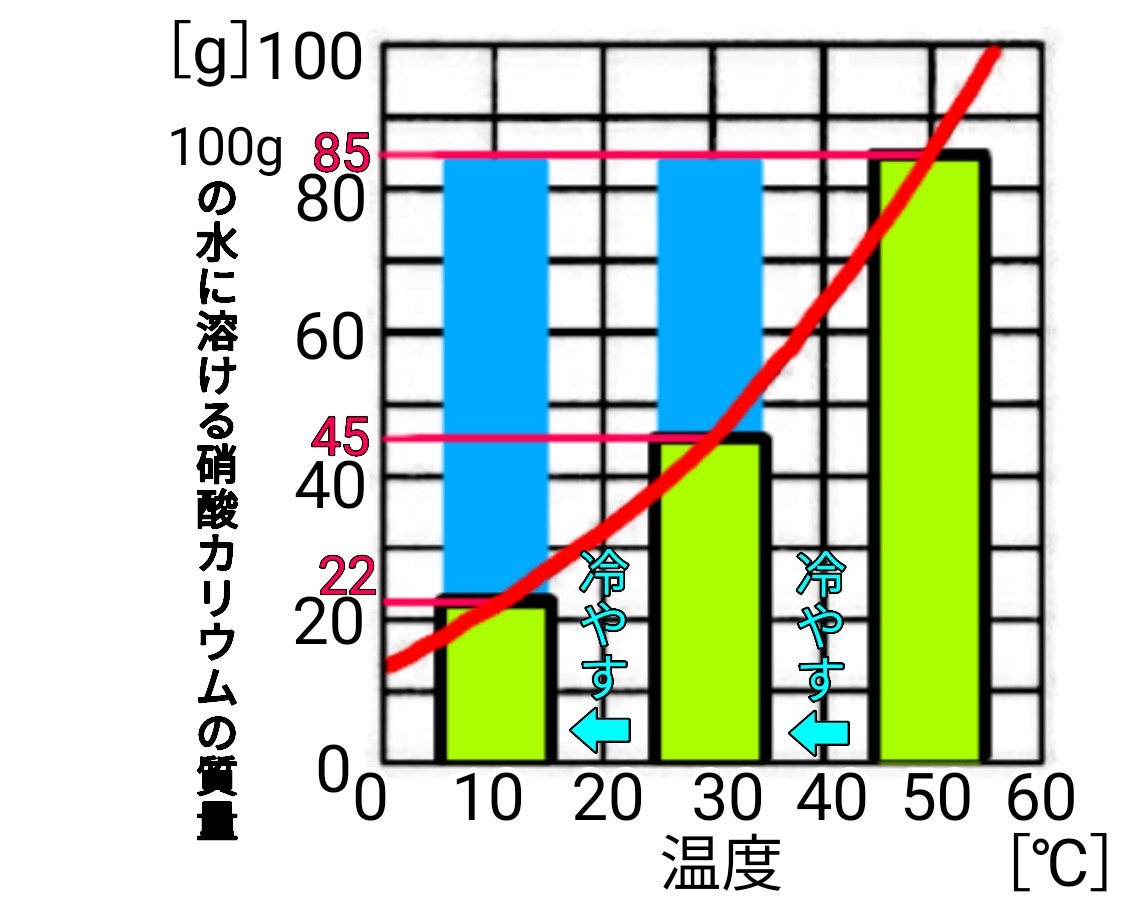
溶解度
100gの水に溶かすことのできる物質の最大質量。
溶解度曲線
ある物質について温度ごとの溶解度を線でつないだグラフ
結晶
平面で囲まれた規則正しい形の固体。物質ごとに形や色が決まっている。
再結晶
水にとかした固体を再び結晶としてとり出すこと。冷却法や蒸発法がある。
混合物と純物質
混合物
2種類以上の物質が混じり合ったもの(例)空気(窒素、酸素、二酸化炭素)、海(水、塩化ナトリウム)
純物質(純粋な物質)
1種類の物質からできているもの。(例)水素、水、銀
粒子のモデルと状態変化
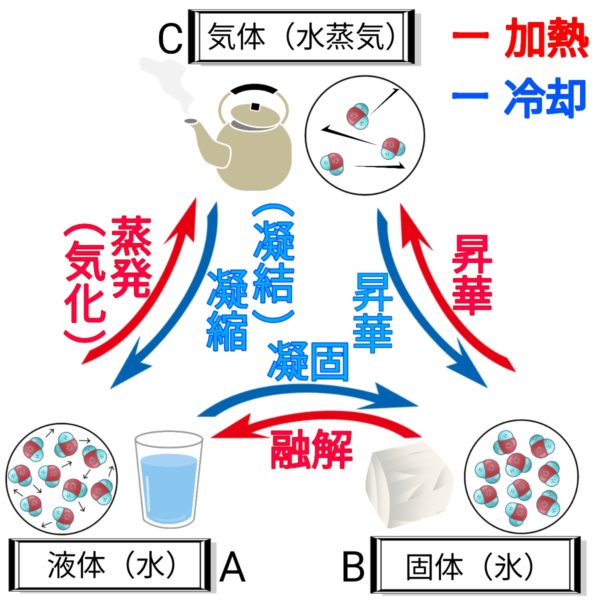
物質の状態
固体、液体、気体の三つの状態がある。
(例)水の場合
| 固体 | 液体 | 気体 |
| 氷 | 水 | 水蒸気 |
状態変化
温度が変わることによって物質が状態を変えること。
状態変化シミュレーター(pHet)
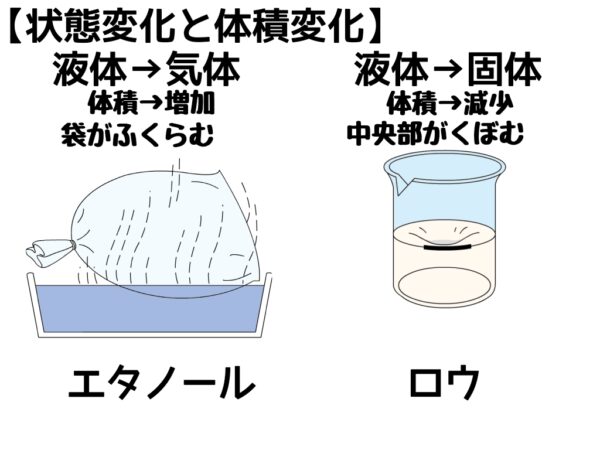
状態変化と体積変化
- 状態変化をしても、質量は変化しないが体積は変化する
- 一般的に固体→液体→気体の順に体積は大きくなる
- 水は例外的に液体より固体の方が体積が大きくなる
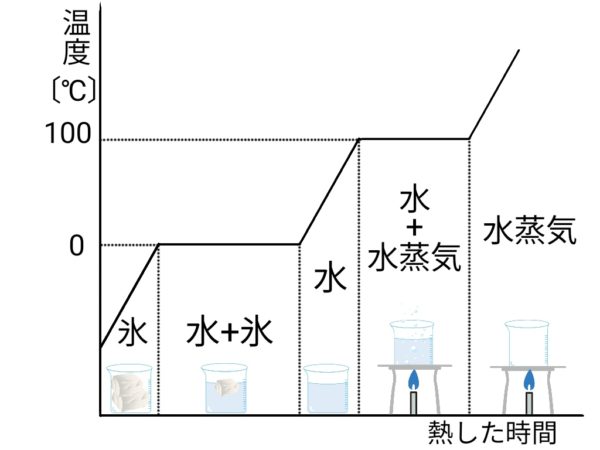
状態変化と温度
純粋な物質の沸点と融点は決まっている
| 固体 | 融点 | 液体 | 沸点 | 気体 | |
| 水 | 0℃ | 100℃ | |||
| 鉄 | 1535℃ | 2750℃ | |||
| ちっ素 | -210℃ | -196℃ |
沸点
液体と気体のさかい目の温度 (例)水の沸点→100℃ エタノールの沸点→78℃
融点
固体と液体のさかい目の温度 (例)水の融点→0℃ エタノールの融点→-114℃
状態変化と温度変化のグラフ
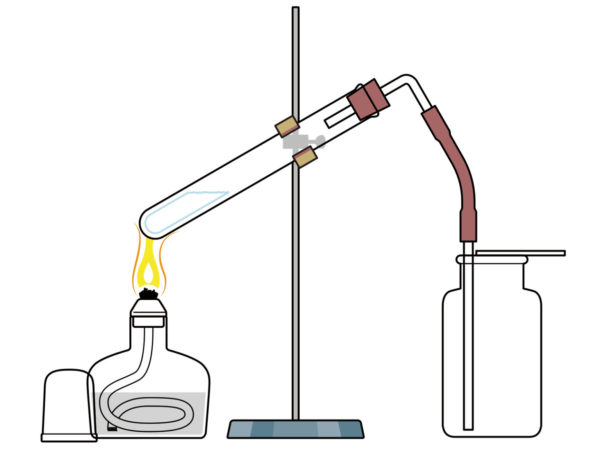
蒸留
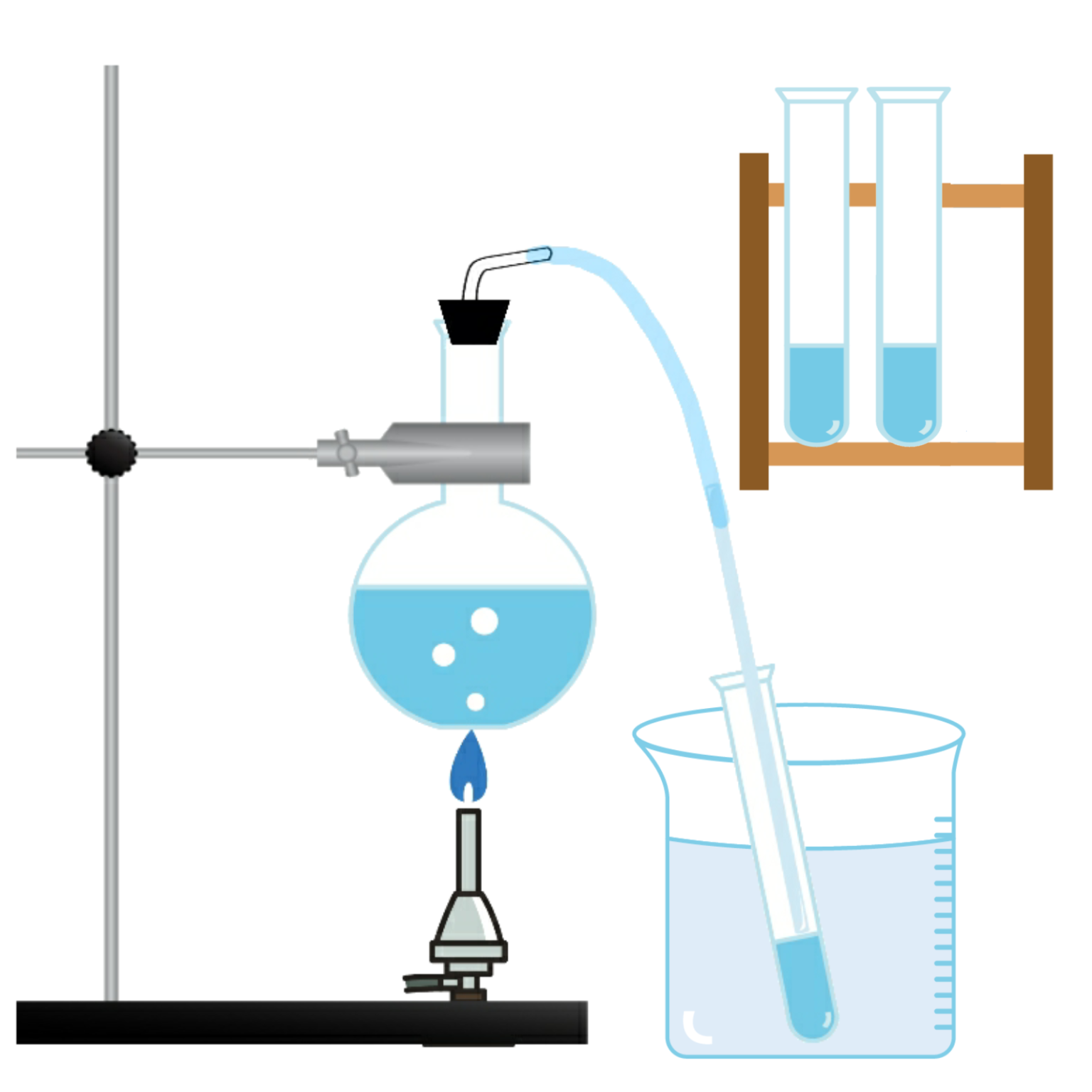
沸点の違いを利用して、混合物から物質を分離すること
(例)水の沸点は100℃、エタノール(アルコール)の沸点は78℃なので、ワインからエタノール(アルコール)を分離することができる。