これで完ぺき!理科の総まとめ(化学変化とイオン)
※イラストをクリックするとデジタル教材で学習することができます。
水溶液とイオン
電流を通す水溶液と通さない水溶液
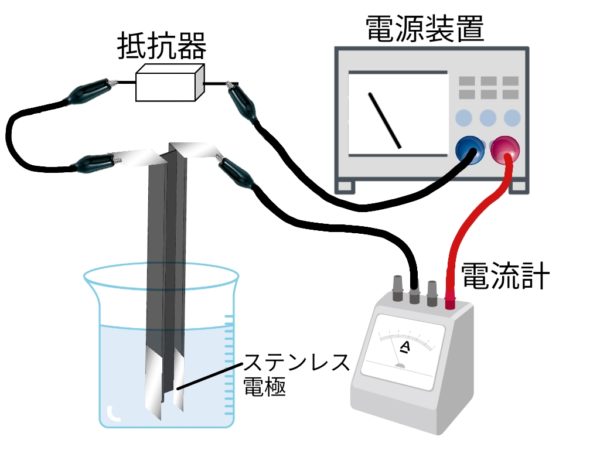
電解質
水に溶かしたとき、電流が流れる物質(例)塩化水素、塩化ナトリウム、塩化銅、水酸化ナトリウム

非電解質
水に溶かしたとき、電流が流れない物質(例)砂糖、エタノール

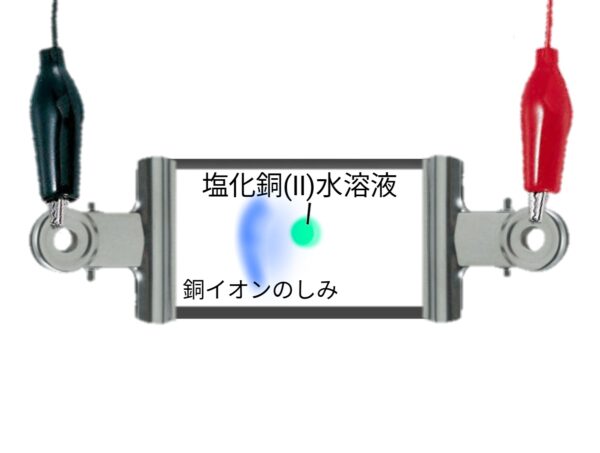
塩化銅水溶液の銅イオンの移動
実験のまとめ
陰極側に銅イオンが移動していることから銅イオンは電気的に+の性質をもち、塩化物イオンは電気的に-の性質をもつことが分かる。
塩化銅水溶液の電気分解
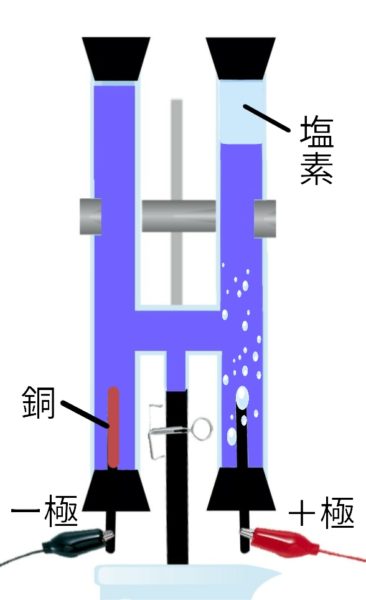
塩化銅 → 銅 + 塩素(陰極:銅、陽極:塩素)
CuCl₂ → Cu + Cl₂
青 赤色 刺激臭、脱色作用
- 陽極→塩素が発生する。(刺激臭、脱色作用、黄緑色)
- 陰極→銅が付着する。(赤色、金属光沢)
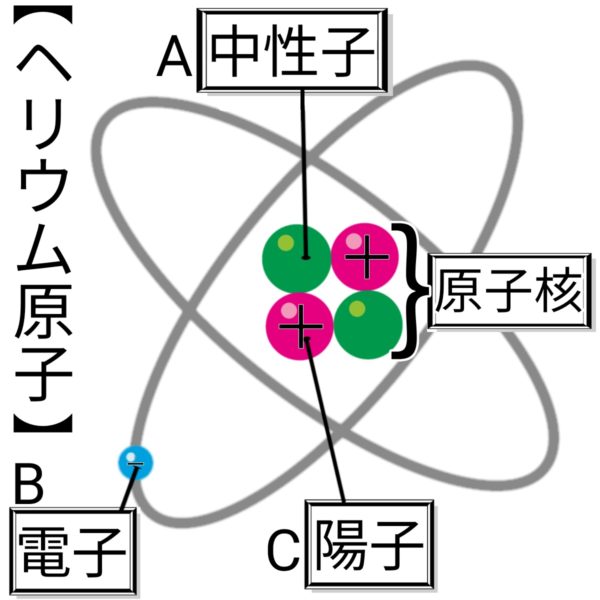
原子のつくり
ヘリウム原子
原子のつくりシミュレーター
原子
物質を構成する最も小さな粒。
原子核
原子の中心にある。陽子と中性子からなる。
陽子
+の電気をもつ。
中性子
電気をもたない。
電子
-の電気をもち、原子核のまわりを飛びまわっている。
※原子の種類によって陽子、中性子、電子の数が異なる。
※原子全体としては陽子と電子の数が等しく電気を帯びていない。
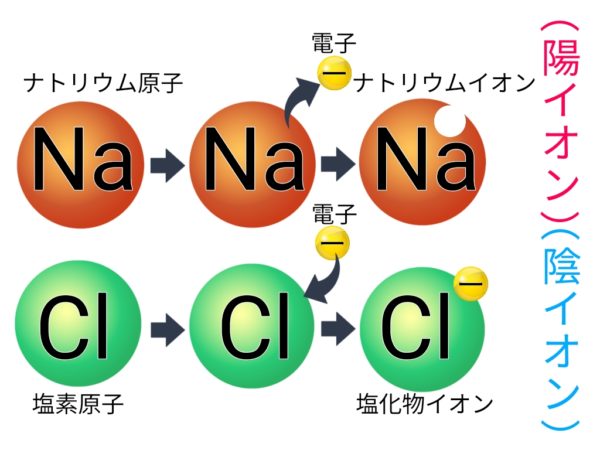
陽イオンと陰イオン
イオン
原子が電子を失ったり受けとったりして電気を帯びたもの。
陽イオン
電子を失って+の電気を帯びたもの
陰イオン
電子を受け取って-の電気を帯びたもの
イオン式
イオンを記号で表したもの
| 1価の陽イオン | 2価の陽イオン | 1価の陰イオン | 2価の陰イオン | ||||
| 水素イオン | H+ | 銅イオン | Cu2+ | 塩化物イオン | Cl- | 硫化物イオン | S2- |
| ナトリウムイオン | Na+ | マグネシウムイオン | Mg²+ | 水酸化物イオン | OH- | 硫酸イオン | SO4²- |
| アンモニウムイオン | NH₄+ | 亜鉛イオン | Zn²+ | 硝酸イオン | NO₃- | ||
電離
電解質が水にとけて陽イオンと陰イオンに分かれること。

電離をイオン式で表す
- 塩化水素の電離
HCl → H+ + Cl- - 塩化ナトリウムの電離
NaCl → Na+ + Cl- - 塩化銅の電離
CuCl₂ → Cu2+ + 2Cl- - 水酸化ナトリウムの電離
NaOH → Na+ + OH- - 硫酸の電離
H₂SO₄ → 2H+ + SO4²- - 硫酸銅の電離
CuSO₄ → Cu²+ + SO4²-
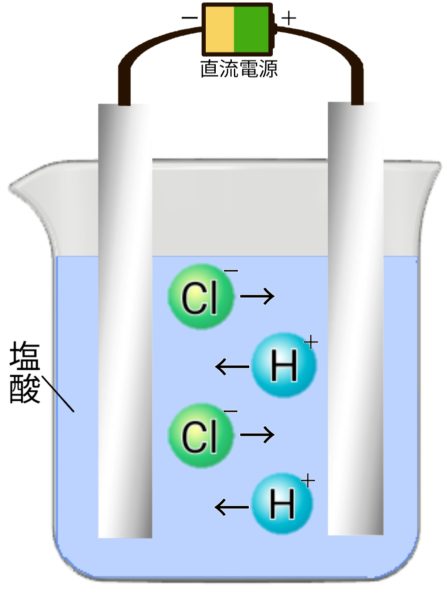
塩酸の電気分解
-
塩化水素 → 水素 + 塩素(陰極:水素、陽極:塩素)
- 陽極→塩素が発生する。(刺激臭、脱色作用、黄緑色)
- 陰極→水素が発生する。(音をたてて燃える)
2HCl₂ H₂ 2Cl₂
化学式とイオン式で表す※電子をeで表すと
電離 HCl → H+ + Cl-
陽極 2Cl- → Cl₂ + 2e-(塩化物イオン → 銅 + 電子)
陰極 2H+ + 2e- → H₂(水素イオン + 電子 → 水素)
化学反応式 2HCl → H₂ + Cl₂(塩酸 → 水素 + 塩素)
塩酸の電気分解モデル
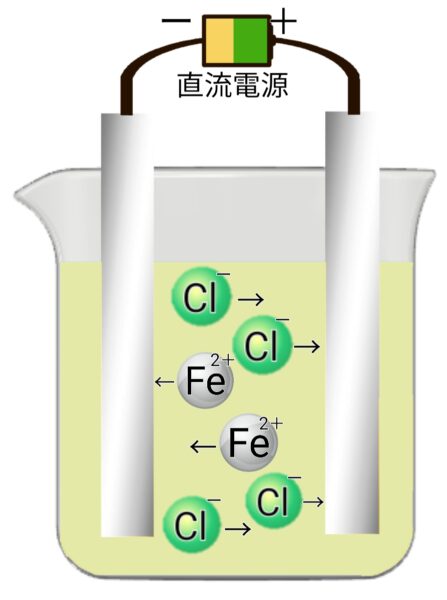
塩化鉄(Ⅱ)の電気分解
-
塩化鉄 → 鉄 + 塩素(陰極:鉄、陽極:塩素)
- 陽極→塩素が発生する。(刺激臭、脱色作用、黄緑色)
- 陰極→鉄が付着する。(白色、金属光沢)
化学式とイオン式で表す※電子をeで表すと
電離 HCl → H+ + Cl-
陽極 2Cl- → Cl₂ + 2e-(塩化物イオン → 塩素 + 電子)
陰極 Fe²+ + 2e- → Fe(鉄イオン + 電子 → 鉄)
化学反応式 FeCl₂ → Fe + Cl₂(塩化鉄 → 鉄 + 塩素)
塩化鉄(Ⅱ)水溶液の電気分解モデル
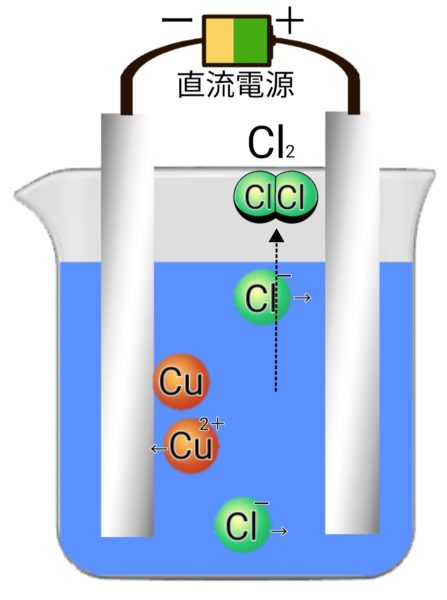
塩化銅水溶液の電気分解

塩化銅 → 銅 + 塩素(陰極:銅、陽極:塩素)
CuCl₂ → Cu + Cl₂
青 赤色 刺激臭、脱色作用
- 陽極→塩素が発生する。(刺激臭、脱色作用、黄緑色)
- 陰極→銅が付着する。(赤色、金属光沢)
化学式とイオン式で表す※電子をeで表すと
電離 CuCl₂ → Cu²+ + 2Cl-
陽極 2Cl- → Cl₂ + 2e-(塩化物イオン → 塩素 + 電子)
陰極 Cu²+ + 2e- → Cu(銅イオン + 電子 → 銅)
化学反応式 CuCl₂ → Cu + Cl₂(塩化銅 → 銅 + 塩素)
塩化銅水溶液の電気分解モデル
電池とイオン
イオンへのなりやすさ
原子によってイオンへのなりやすさが異なる。
イオンになりやすい Na>Mg>Al>Zn>Fe>Cu イオンになりにくい
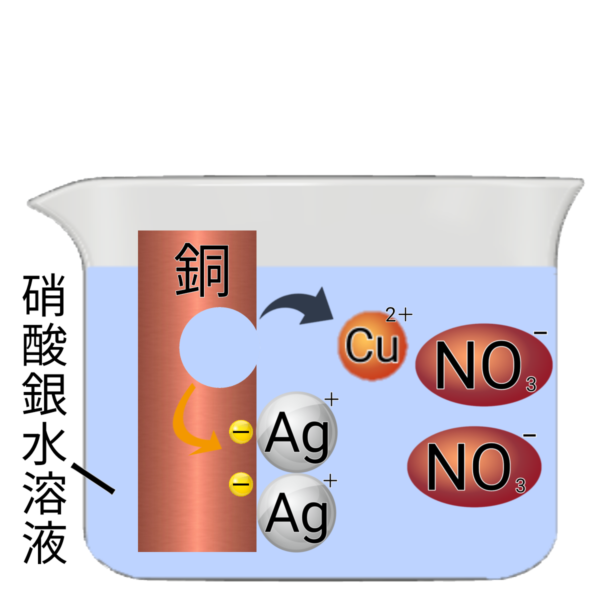
硝酸銀水溶液に銅を入れる実験
銅と銀では銅の方がイオンになりやすいため、硝酸銀水溶液に銅を入れると、銅が溶け出してイオンになり、銀が析出する。
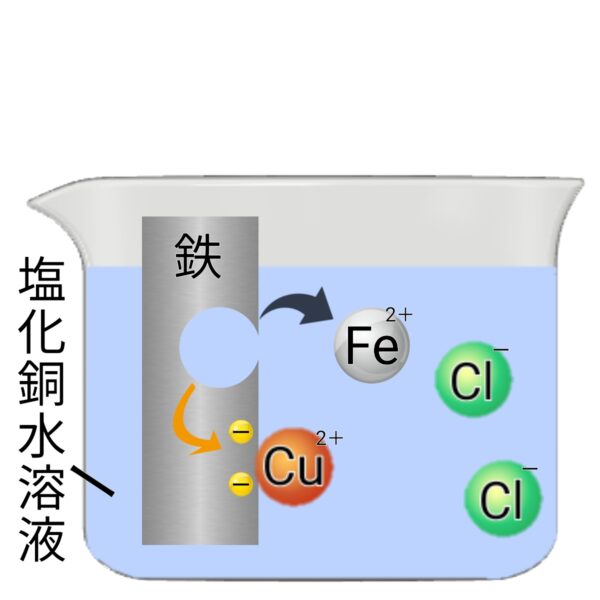
塩化銅水溶液に鉄を入れる実験
銅と鉄では鉄の方がイオンになりやすいため、塩化銅水溶液に鉄を入れると、鉄が溶け出してイオンになり、銅が析出する。
化学電池
物質のもっている化学エネルギーを化学変化によって電気エネルギーに変換する装置。充電のできない一次電池と充電のできる二次電池がある。
電池の基本構造
電解質の水溶液に2種類の金属が入っている。金属の組み合わせで電圧が決まる。
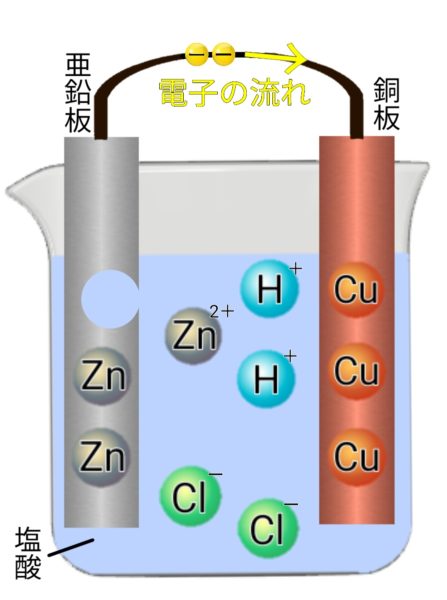
ボルタ電池
ダニエル電池
亜鉛板、銅板、硫酸亜鉛水溶液、硫酸同水溶液、飽和食塩水、ろ紙、セロファンで作ることができる。
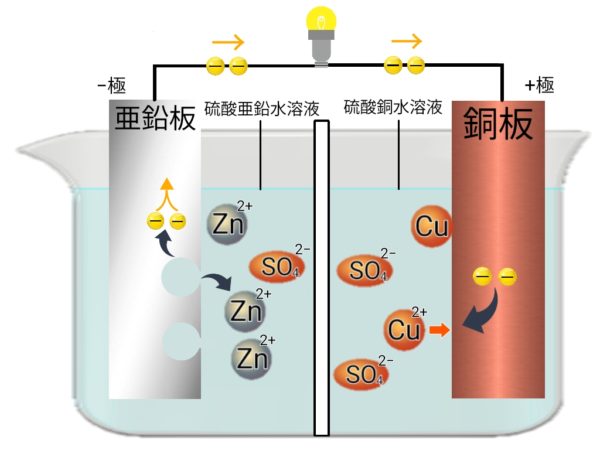
電池の中で起こる変化
-極(亜鉛版)Zn → Zn²+ + 2e-
+極(銅板)Cu²+ + 2e- → Cu
電池の種類
一次電池
- マンガン乾電池 価格が安い。休ませながら使うと長持ちする(例)懐中電灯、リモコン

- アルカリ乾電池 マンガン乾電池より取り出せる電流が大きく、二倍以上長持ちする(例)懐中電灯、モーター

- リチウム電池 電圧が高く、長持ちする。寒くても使える。使わない場合は電池の容量が減らない(例)腕時計、電卓
- 酸化銀電池 電圧が安定していて長持ちする(例)腕時計、精密機器
- 空気亜鉛電池 とり出せる電流は小さいが、連続して長く使える(例)補聴器
二次電池
- 鉛蓄電池 価格が安く、電圧が高い、小型化が難しい(例)自動車用バッテリー、非常用電源

- ニッケル水素電池 価格が安く、長持ち、素早く充電できる(例)ゲーム機、ハイブリッド自動車
- リチウムイオン電池 軽量で、電圧が高い。価格が高い(例)携帯電話、ノートパソコン

燃料電池
水の電気分解の逆の変化で電流をおこす電池
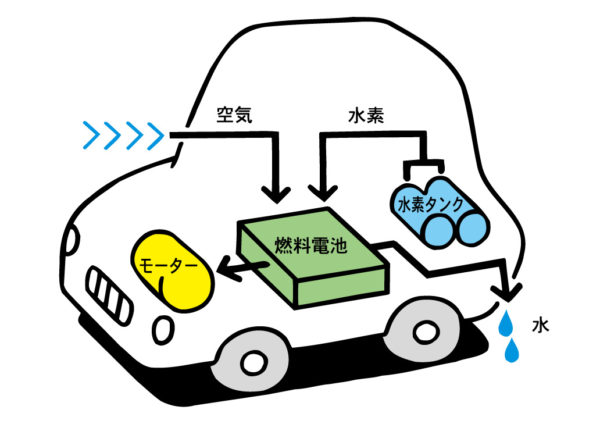
水の電気分解 2H₂O + 電気エネルギー→ 2H₂ + O₂
燃料電池 2H₂ + O₂ + 電気エネルギー→ 2H₂O
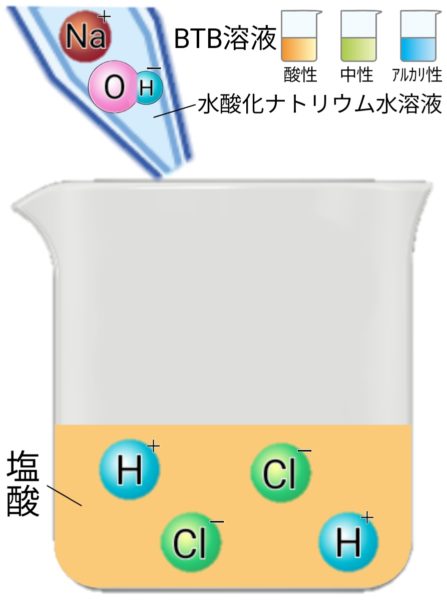
酸とアルカリ
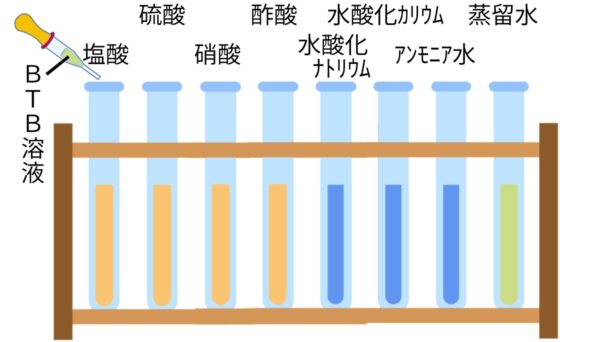
指示薬
BTB溶液
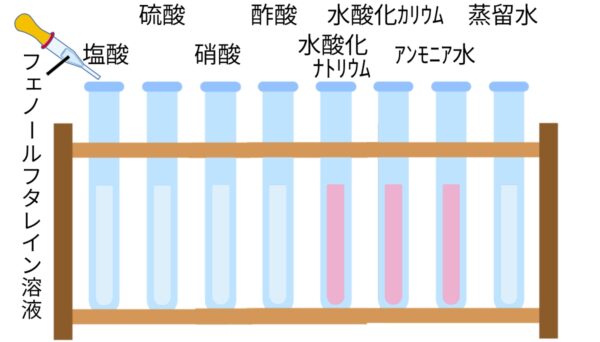
フェノールフタレイン溶液
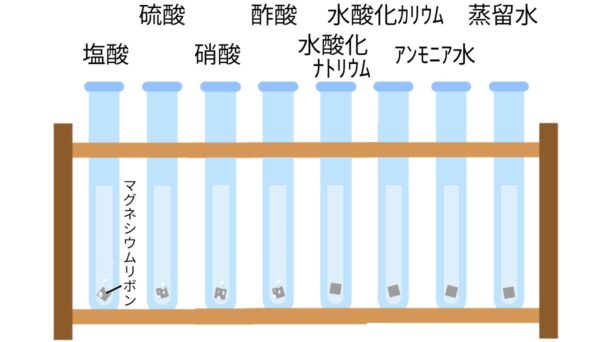
金属(Mg)との反応
酸とアルカリシミュレーター1
酸とアルカリの正体
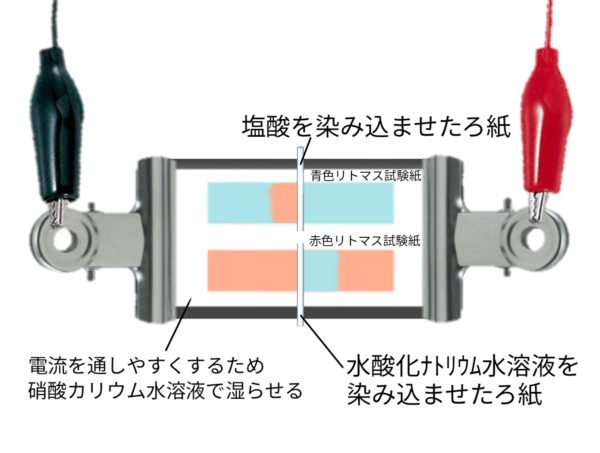
リトマス試験紙をつかった実験
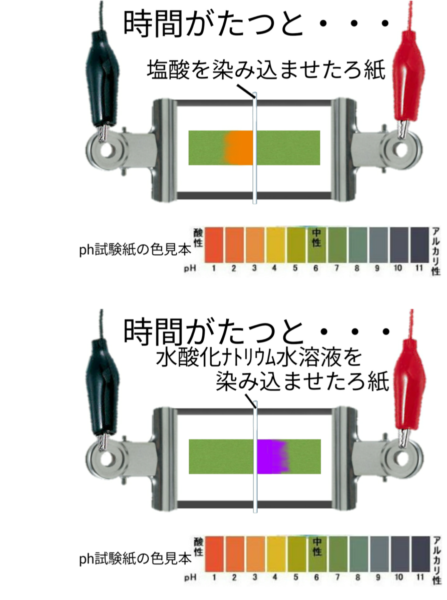
pH試験紙をつかった実験
酸
水溶液にしたとき、電離して水素イオン(H+)を生じる化合物(例)塩酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)

アルカリ
水溶液にしたとき、電離して水酸化物イオン(OH-)を生じる化合物(例)水酸化ナトリウム(NaOH)、水酸化カリウム(KOH)、アンモニア(NH3)
※アンモニアは水にとけることでOH-を生じる
pH(ピーエイチ)
酸性、アルカリ性の強さを表す単位。pH7を中性とし、値が小さいほど酸性、値が大きいほどアルカリ性を表す。
酸とアルカリを混ぜるとどうなるのか
中和
酸とアルカリの水溶液を混ぜ合わせたとき、水素イオンと水酸化物イオンが結びついて水をつくり、互いの性質を打ち消し合う反応
酸とアルカリシミュレーター2
塩(えん)
酸の陰イオンとアルカリの陽イオンが結びついてできた物質
硫酸と水溶液バリウムの中和
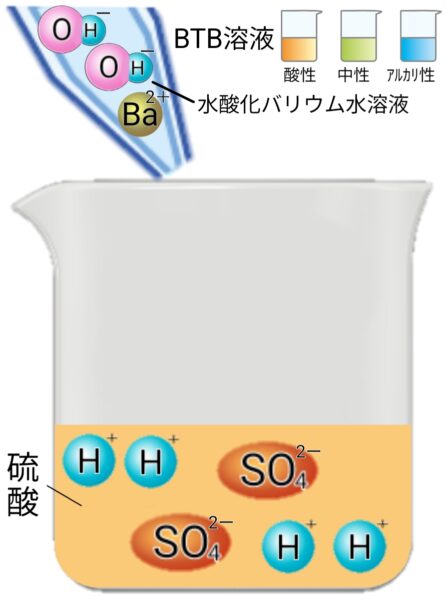
塩(硫酸バリウム)は水に溶けずに沈殿するため、水溶液が白く濁る