これで完ぺき!理科の総まとめ(化学変化と原子・分子)
※イラストをクリックするとデジタル教材で学習することができます。
物質の成り立ち
化学変化(化学反応)
もとの物質とは性質の異なる別の物質ができる変化。
※状態変化は状態が変わるだけで同じ物質(氷⇔水⇔水蒸気)
分解
1種類の物質が2種類以上の別の物質に分かれる化学変化。物質を加熱したときに起こる分解を特に熱分解という。また、電流を流した時に起こる分解を特に電気分解という。
炭酸水素ナトリウムの分解(熱分解)
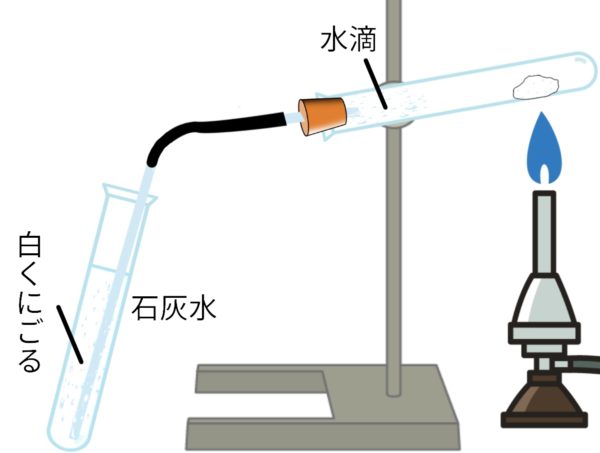
炭酸水素ナトリウム → 炭酸ナトリウム + 二酸化炭素 + 水
2NaHCO₃ → Na₂CO₃ + CO₂ + H₂O
弱アルカリ性 アルカリ性 石灰水→白 塩化コバルト紙 青→赤

酸化銀の分解(熱分解)
酸化銀 → 銀 + 酸素
2Ag₂O →2Ag + O₂
黒 金属光沢 助燃性
水の電気分解
水 → 水素 + 酸素(陰極:水素、陽極:酸素)
2H₂O → 2H₂ + O₂
燃える 助燃性
物質の表し方
原子
物質をつくっていて、それ以上分けることのできない小さな粒。物質を構成する原子の種類のことを元素という。
※原子と元素の違い
水分子は3つの原子でできている(水素原子2つ、酸素原子1つ)
水分子は2つの元素でできている(水素と酸素)
ドルトン(1766〜1844年)

イギリスの科学者で「物質はそれ以上分割できない原子という粒子からできている」という原子説を発表した。
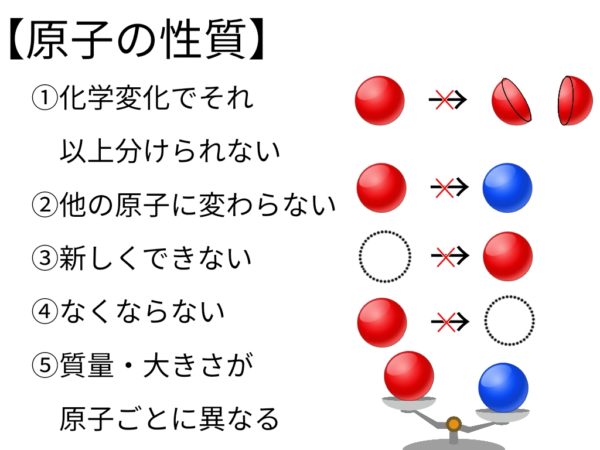
原子の性質
- それ以上分けられない
- 他の原子に変わらない
- なくならない
- 新しくできない
- 質量・大きさが原子ごとに異なる
元素記号
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
水兵 リーベ 僕 の 船 なんで曲がるシップス クラークか
周期表
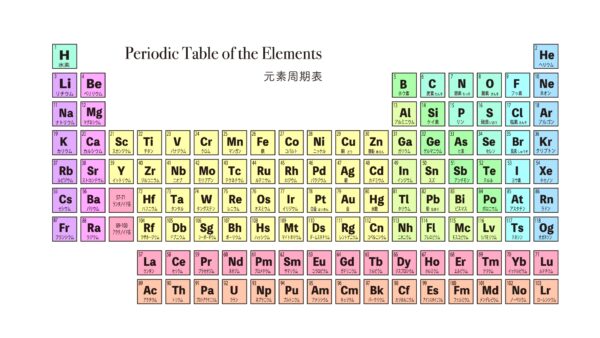
物質を構成する基本単位である元素を、それぞれが持つ物理的または化学的性質が似たもの同士が並ぶように決められた規則(周期律)に従って配列した表
メンデレーエフ(1834〜1907年)

ロシアの科学者で、それまで知られていた約60種類の元素を原子の質量の順に並べると、性質の似たものが周期的に現れることを見いだし、現在の周期表を考案した。
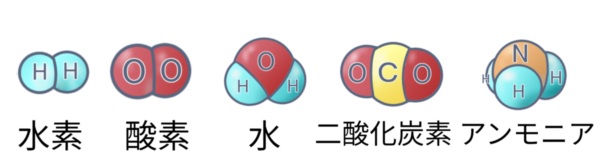
分子
原子がいくつか結びついてできている物質の性質を表す最少の粒。決まった種類の原子が決まった数結びついてできている。
(例)水素分子 → 水素原子2個、水分子 → 水素原子2個と酸素原子1個
分子のモデル
水分子3Dモデル🚰
アボガドロ(1776〜1856年)

イタリアの科学者で、ドルトンの原子説を一歩進め「気体は2個以上の原子が集まった分子でできている」という考え方を発表した。
物質の種類
混合物
2種類以上の物質が混じり合ったもの(例)空気(窒素、酸素、二酸化炭素)、海(水、塩化ナトリウム)
純粋な物質(純物質)
1種類の物質からできているもの。単体と化合物に分けられる。(例)水素、水、銀
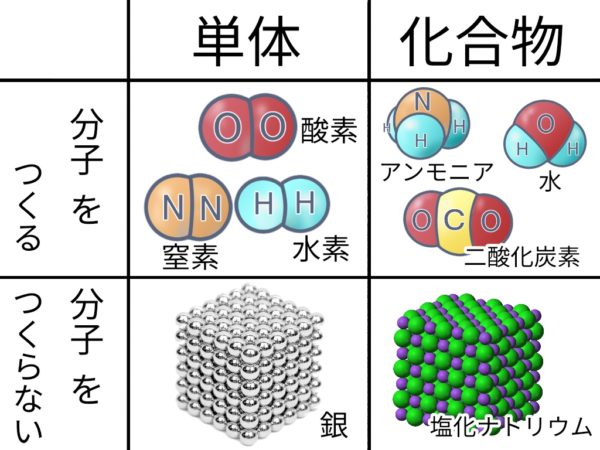
単体
1種類の原子からできているもの。(例)水素、酸素、銀
化合物
2種類以上の原子からできているもの。(例)水、二酸化炭素
単体・化合物のまとめ
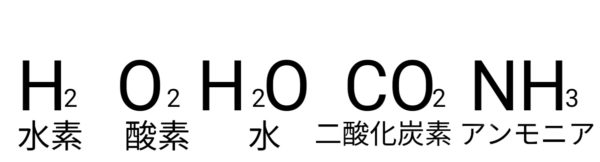
化学式
化学式の書き方
分子をつくる物質
- 分子のモデルを記号に置き換える
- 原子をまとめて個数を右下に書く
(例)○○→HH→H₂、◎●◎→OCO→CO₂
分子をつくらない物質
※1個の原子、または組になっている原子で代表させる。
化学反応式
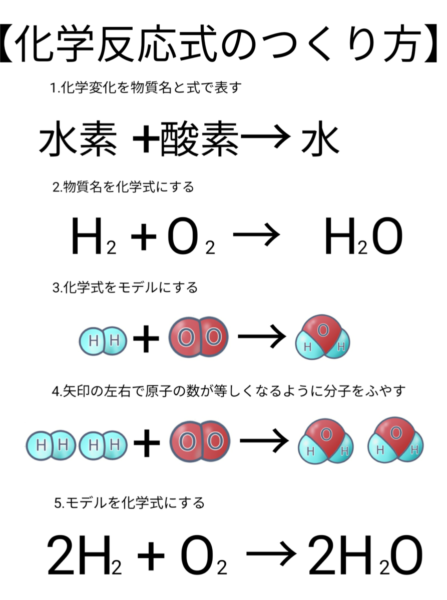
化学反応式のつくり方
1. 化学変化を物質名と式で表す。
2. 物質名を化学式にする。
3. 化学式をモデルにする。
4. 矢印の左側と右側で原子の数が等しくなるように分子を増やす。
5. モデルを化学式にする。
化学反応式シミュレーター1
さまざまな化学変化
物質が結びつく化学変化
2種類以上の物質が結びついてできた化合物ができる。
(例)水素 + 酸素 → 水、 鉄 + 硫黄 → 硫化鉄、 銅 + 硫黄 → 硫化銅
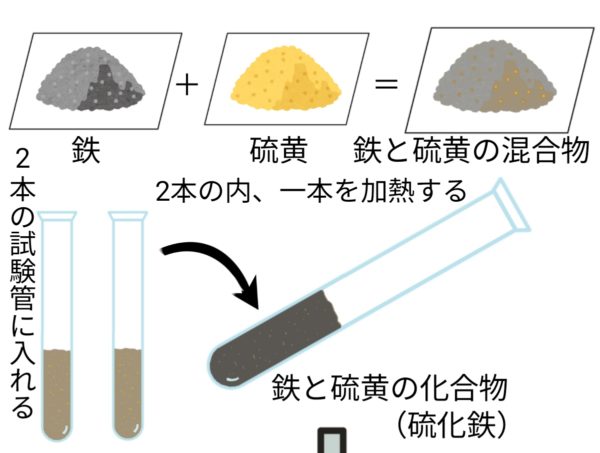
鉄と硫黄が結びつく化学変化
| 硫化鉄(化合物) | 鉄と硫黄の混合物 | |
| 色・見た目 | 黒、固まり | 灰色、粉末 |
| 磁石 | 引きつけられない(弱い) | 引きつけられる |
| 希塩酸 | 腐卵臭(硫化水素) | 無臭(水素) |
※鉄と硫黄が結びつく時に熱が発生するため、一部が赤くなったところで加熱を止めても反応は続く。
硫化
物質が硫黄と結びつくこと
物が燃える変化
鉄(スチールウール)の加熱
鉄 + 酸素 → 酸化鉄
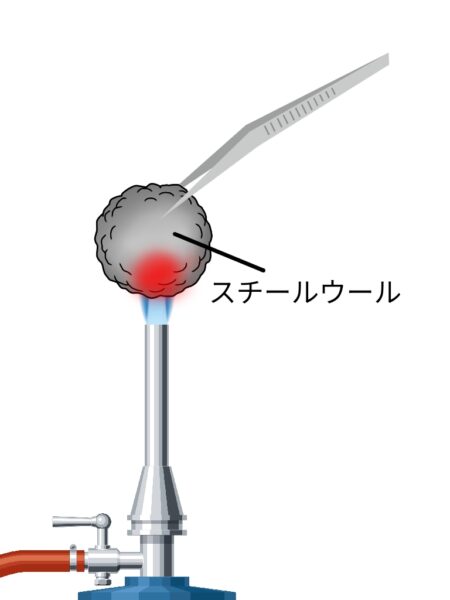
| 加熱後 | |
| 質量 | 質量が増加した |
| 電流を通すか | 電流を通さなくなった |
| 塩酸との反応 | 気体が発生しなくなった |
| 見た目 | 光沢のある灰色から黒に変化した |
酸化
物質が酸素と化合すること。酸化してできた物質を酸化物という。
燃焼
激しく熱や光を出しながら酸化すること。

物質 + 酸素 → 酸化物
↑この時に熱や光が発生すれば燃焼
鉄の燃焼実験動画
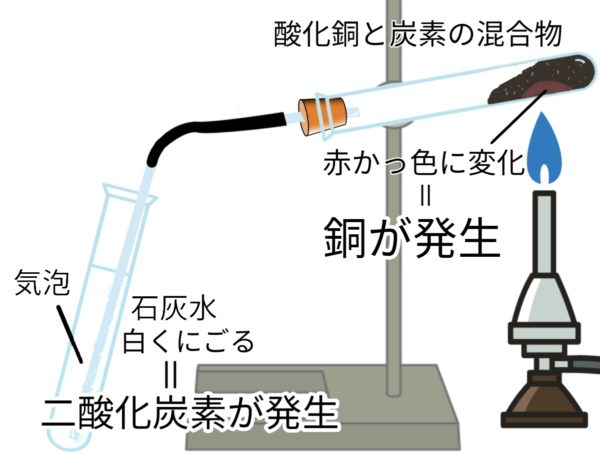
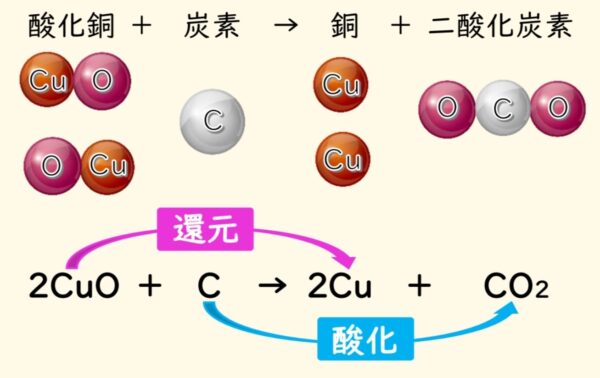
酸化物から酸素をとり除く変化
還元
酸化物が酸素を奪われる化学変化。酸化と同時に起こる。
化学変化と熱の出入り
発熱反応
化学変化のときに熱の発生をともない、まわりの温度を上げる反応。
- (例1)鉄+酸素→酸化鉄(化学カイロ)
- (例2)酸化カルシウム+水(駅弁)

吸熱反応
化学変化のときに周囲の熱を吸収し、まわりの温度を下げる反応。
- (例1)炭酸水素ナトリウム+クエン酸+水 ⇒ 二酸化炭素が発生して温度が下がる
- (例2)水酸化バリウム+塩化アンモニウム⇒アンモニアが発生して温度が下がる

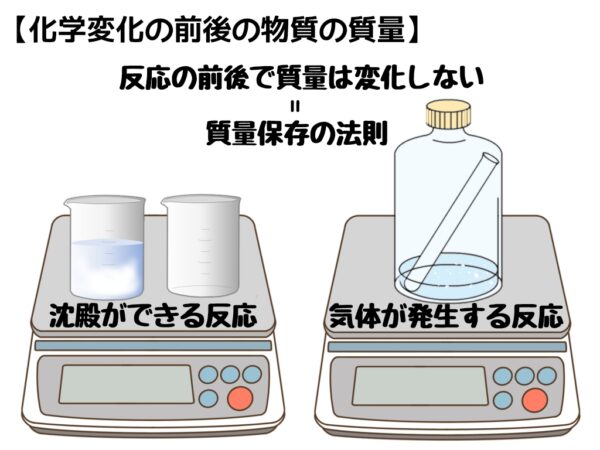
化学変化と物質の質量
質量保存の法則
化学反応の前後で物質全体の質量は変わらない。
化学変化と質量変化
銅と化合する酸素の質量
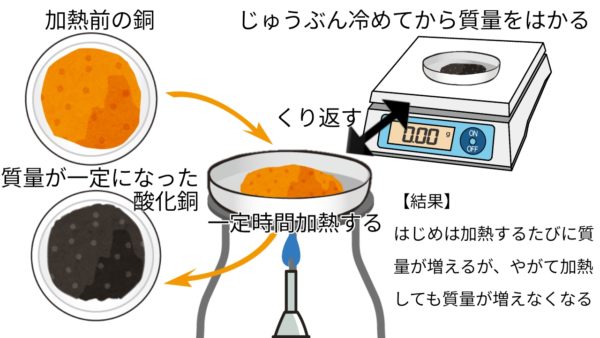
銅 + 酸素 → 酸化銅(※銅を加熱すると重くなる)
2Cu + O₂ → 2CuO
銅と化合する酸素の量には限界がある
定比例の法則
物質が化学反応する時、反応に関わる物質の質量の割合は、常に一定である
- (例1)銅+酸素→酸化銅 ⇒ 銅:酸素:酸化銅=4:1:5
- 「覚え方」指導される一人の酸素
- (例2)マグネシウム+酸素→酸化マグネシウム ⇒ マグネシウム:酸素:酸化マグネシウム=3:2:5
- (例3)鉄+硫黄→硫化鉄 ⇒ 鉄:硫黄:硫化鉄=7:4:11
木炭の加熱
炭素 + 酸素 → 二酸化炭素(※木炭を加熱すると軽くなる)
C + O₂ → CO₂